MDR - Medical Devices Regulation (EU) 2017/745
유럽 (EU) 의료기기 규정의 복잡성을 해결하고 EU 시장에 접근할 수 있도록 도와드립니다
2017년 5월 5일, 의료기기 규정(MDR)과 체외진단의료기기 규정(IVDR)이 제정되었으며, 2017년 5월 25일부터 시행되었습니다. MDR 적용일은 2021년 5월 26일이며, 해당 기간 이후, 기존 인증을 전환하지 못한 의료기기는 MDR 요건을 충족해야유럽시장에 의료기기를 출시할 수 있습니다.
영국 시장 진출을 위한 UKCA 인증
영국 정부는 2021년 1월 1일부터 새로운 인증 마크인 UKCA(UK Conformity Assessed)를 도입했습니다. 의료기기에 대한 UKCA 인증 전환 기한은 2023년 6월 30일까지로 설정되어 있습니다. 영국 시장에 제품을 출시하려는 제조업체는 반드시 UKCA 인증 요구사항을 준수해야 합니다.
MDR 주요 목적
MDR은 기존 지침을 대체하며, 다음의 주요 목적을 위해 규정을 강화했습니다:
- 유럽 시장 출시 제품의 품질, 안전성 및 신뢰성 향상
- 소비자 및 의료인을 위한 의료기기 정보의 투명성 확보
- 의료기기 사후관리 및 시장 감시 체계 강화
이러한 변화는 제조업체의 역할(제조업자, 수입업자, 유럽 대리인)과 제품의 등급 분류에 따라 차등적으로 영향을 미칩니다. 새로운 규정에 따라 기존보다 더 높은 수준의 품질경영시스템(QMS) 및 기술문서 적합성 평가가 요구됩니다.
See an overview of some of the key changes here.
MDD 인증의 유효성 및 전환 요건
MDD 인증은 인증서의 만료기한과 2024년 5월 26일 중 더 이른 일자까지 유효합니다. 해당 기한까지 MDD 인증을 유지하기 위해서는 MDD의 적합성을 유지하고, 일부 MDR 요구사항을 충족하며 Notified Body의 사후관리를 받아야 합니다.
따라서, 제조사는 2024년 5월 26일까지 MDD 인증기기들을 판매할 수 있습니다. 단, 2020년 5월 26일 시점 부터 현재까지 주요한 변경사항이 있었어선 안됩니다. 기기에 주요한 변경사항을 적용하기 위해서는 MDR에 따른 인증전환이 필요합니다.
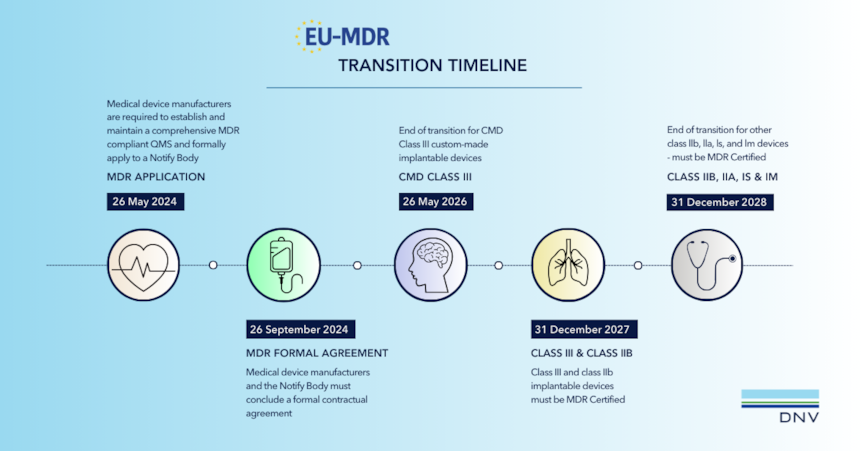
See an infographic of the transition timeline here.
MDD 인증의 MDR 전환
MDD와 IVDD에서 사용하던 개념과 요구사항들이 MDR과 IVDR에 남아 있어 기존 요구사항이 개정된 것으로 보일 수 있지만, 새로이 신설되고 변경된 요구사항들을 고려하면 새로운 규정이 제정된 것으로 보시는 것이 맞습니다. 새로운 규정에는 제조사가 MDR 또는 IVDR 인증을 신청하기 전에 확인하셔야 하는 요구사항들이 상당히 많습니다.
MDR의 인증 신청은 법적 제조자(Legal Manufacturer)가 신청 해야 하며, MDR 인증 후 새로운 인증 주기에 따라 5년 간 유효하게 됩니다. 제조사는 인증을 위해, Notified Body로 부터 기술문서 검토와 최초 현장심사를 성공적으로 완료 해야 합니다. 기술문서는 샘플링 기반으로 검토되나, Class IIb 이식형 기기 또는 Class III 기기는 샘플링 없이 모두 검토됩니다. 제조사는 신청서를 접수하기 전에 기술문서 및 Dossier가 MDR에 적합하게 구비되었음을 보장해야 합니다.
DNV의 MDR 지정
DNV는 의료기기 규정(EU) 2017/745(MDR)의 Notified Body 2460으로 지정받아, Class III를 포함한 모든 등급의 기기에 대한 인증 서비스를 제공합니다. ISO 13485 및 기타 규정에 따른 품질경영시스템(QMS) 인증을 통해 귀사의 유럽 및 영국 시장 진출을 지원합니다.
DNV는 기존 MDD 인증기관으로 지정된 DNV GL Presafe와 Presafe Denmark AS를 통합합니다. 이는 DNV의 기술자원 (20개국, 140여명의 전문가)을 단일 Notified Body 시스템 하에 두어, 고객들에게 더 효과적인 서비스를 제공하기 위함입니다.
또한, 체외진단의료기기 규정(EU) 2017/746(IVDR) Notified Body로 지정받기 위한 신청을 완료했으며, 빠르게 성장 중인 체외진단 의료기기 시장에서도 전문적인 서비스를 제공할 준비를 갖추고 있습니다.
MDR 인증 절차
새로운 규정은 기존 개념과 요구사항을 포함하되, 새로운 요건을 추가적으로 명시하고 있습니다. MDR 인증 신청은 법적 제조자가 수행해야 하며, 인증 완료 후 인증서는 5년간 유효합니다. 기술문서는 Class IIb 이식형 기기 및 Class III 기기의 경우 모든 내용을 검토하며, 다른 기기는 샘플링 기반으로 검토합니다.
인증 준비
MDD에서 MDR로 인증을 전환하거나 MDR 신규 인증 전에, 우선적으로 MDR규정과 요구사항들을 숙지하는 것이 중요합니다. 앞서 언급했다시피 품질경영시스템과 기술문서 적합성 평가 절차에 상당한 차이가 있습니다.
DNV는 귀사 품질경영시스템의 MDR인증 준비 상태를 진단할 수 있는 무료 진단 툴을 제공합니다.진단 툴은 저희 웹사이트 https://ready.dnvgl.com/*를 통해 사용하실 수 있으며, 등록을 위해서는ready.support@dnv.com로 연락해 주시기 바랍니다.
귀사의 제품에 CE 마킹하기 위해서는 Notified Body 의 인증이 필요합니다. 영국 시장에 제품을 출시하기 위해서는, UKCA 인증이 필요한 점 참고바라며, UKCA 인증의 전환기한은 2023년 6월 30일 까지 입니다.
DNV는 ISO 13485(의료기기 품질경영시스템)을 비롯하여 모든 시장진입을 위한 표준의 교육부터 인증준비와 인증을 받는데 까지 귀사의 여정을 지원할 수 있습니다.
*주의: 위에 제공한 MDR 준비 상태 진단 체크리스트는 ISO 13485:2016에 요구사항에 MDR의 추가적인 요구사항을 포함합니다. 무료 체크리스트를 개발한 목적은 제조사로 하여금 MDR 준비 상태를 자가진단할 수 있는 툴을 제공하기 위함이며, 체크리스트의 진단 결과는 MDR에 준수함을 보장하지 않습니다.


